Anwendungen von Gene Drives
Gene Drives eröffnen zahlreiche neue Anwendungsmöglichkeiten.
Aktuell konzentriert sich die Forschung auf drei Gebiete:
- die Kontrolle von Krankheitsüberträgern
- das Entfernen invasiver Arten aus empfindlichen Ökosystemen und
- das Eindämmen sogenannter Schädlinge in der Landwirtschaft.
Gene Drives zur Beseitigung von Krankheitsüberträgern
Infektionskrankheiten wie Malaria, Dengue-Fieber und Borreliose werden von Mücken oder Zecken auf den Menschen übertragen. Die Bekämpfung dieser Überträger – auch „Vektoren“ genannt – ist Teil der Krankheitsprävention.
Gene Drives sollen diese Bemühungen auf eine neue Ebene heben.
Der Malaria-Erreger wird durch verschiedene Arten von Anopheles Mücken verbreitet. Ein konzertiertes globales Programm der Malariakontrolle unter Einsatz von Moskitonetzen, Insektiziden und Medikamenten hat dazu beigetragen, die Krankheit in vielen Regionen der Welt zurückzudrängen und die Zahl der Todesopfer zwischen den Jahren 2000 und 2015 um etwa die Hälfte zu senken.1 Im Jahr 2016 identifizierte die WHO 21 Länder mit dem Potential, bis 2020 das Ziel von null einheimischen Malariafällen zu erreichen.
Dabei sind bereits 39 Länder als malariafrei zertifiziert2 , zuletzt Sri Lanka (2016), Paraguay (2018), Algerien (2019) und El Salvador (2021). Auch China, Malaysia, El Salvador und der Iran sind auf einem guten Weg, die für die Zertifizierung notwendige dreijährige Malariafreiheit zu erreichen. Weitere Faktoren für die erfolgreiche Bekämpfung der Krankheit sind vor allem ein starker politischer Wille, ein funktionierendes Gesundheitssystem, eine gute Ausbildung des medizinischen Personals, nationale Programme für Aufklärungs- und Präventionsmaßnahmen, medizinische Überwachungsprogramme, schnelle und richtige Diagnose sowie Behandlung und schnelle Reaktionen auf auftretende Krankheitsausbrüche.3 Doch es verbleiben noch immer 87 Länder, in denen solche Maßnahmen nicht ausreichend umgesetzt werden konnten. Im Jahr 2017 erkrankten mehr als 200 Millionen Menschen an Malaria, über 400 000 Menschen starben daran. Am stärksten ist die Subsahara-Afrika betroffen, vor allem bei Kindern unter fünf Jahren ist die Sterblichkeit sehr hoch.4 Gene Drives sollen hier Abhilfe schaffen, indem sie die Zahl der Anopheles Mücken in Afrika und damit auch die Übertragung der Malaria massiv reduzieren.
Eine führende Rolle bei der Entwicklung derartiger Gene Drives spielt das internationale Forschungskonsortium Target Malaria. Dem Konsortium steht ein Etat von etwa 100 Millionen US-Dollar zur Verfügung, das zum großen Teil aus Mitteln der Bill & Melinda Gates Foundation5 sowie dem Open Philantrophy Projekt6 stammt.
Die Pläne von Target Malaria sind schon so weit, dass erste Modellprojekte in Burkina Faso, Mali, Ghana und Uganda gestartet wurden.
Zur Kontrolle der Mückenpopulationen verfolgt Target Malaria zwei unterschiedliche Ansätze:
Ansatz 1: Sterilität erzeugen
Einer zielt darauf ab, sterile weibliche Anopheles Mücken durch die Veränderung eines Gens namens Doublesex zu erzeugen. Mit einem CRISPR/Cas9 Gene Drive soll diese gentechnische Veränderung in der wildlebenden Population verbreitet werden. Im Jahr 2018 zeigten Versuche in großen Käfigen, dass dieser Ansatz grundsätzlich funktioniert: Der Gene Drive brachte die Population nach etwa zehn Generationen zum Zusammenbruch.7
Ansatz 2: Geschlechterteilung verändern
Der zweite Ansatz von Target Malaria sieht vor, die Geschlechterverteilung der Mücken zu manipulieren, sodass nur noch männliche Mücken zur Welt kommen. Dieser Ansatz wird in einem Projekt in Burkina Faso in drei verschiedenen Phasen getestet, bei dem erst in der dritten Phase ein Gene Drive zum Einsatz kommen soll.
In der ersten Phase wurden männliche Mücken mittels Gentechnik fortpflanzungsunfähig gemacht.8 Freilandversuche mit diesen sterilen Mücken wurden im Jahr 2019 in Burkina Faso durchgeführt.9 Diese Vorversuche zielen laut Target Malaria darauf ab, Erfahrungen vor Ort zu sammeln und die Bevölkerung in Burkina Faso mit solchen Versuchen vertraut zu machen. Obwohl Target Malaria darauf hinweist, die lokale Bevölkerung in den Entscheidungsprozess eingebunden zu haben, sorgten bereits die bisherigen Experimente sowohl in Burkina und international für Proteste.10 11
In der zweiten Phase sollen die Mücken gentechnisch so verändert werden, dass sie überwiegend männliche Nachkommen erzeugen12 . Die über einen sogenannten X-Shredder (siehe Abbildung) eingeführte gentechnische Veränderung würde sich nach den Mendelschen Regeln vererben. Somit handelt es sich in dieser Phase noch nicht um einen Gene Drive. Um die Mückenpopulation mit diesen Freisetzungen zu reduzieren, müssten immer wieder im Labor erzeugte gentechnisch veränderte Mücken in hohen Mengen freigesetzt werden.
Das Ziel von Target Malaria in der dritten Phase ist es, Mücken herzustellen, die den X-Shredder auf dem Y-Chromosom tragen, wodurch alle Nachkommen über Generationen hinweg männlich wären und alle den X-Shredder in sich tragen. Die gentechnische Veränderung breitet sich also wie ein Gene Drive in der gesamten Population aus.13
Während Target Malaria darauf setzt, die Zahl der Mücken zu verringern, gehen Gene Drive Entwickler*innen an der Universität von Kalifornien in San Diego einen anderen Weg. Mit einer Ausstattung von mehreren Millionen US-Dollar der indischen Tata-Stiftung14 suchen sie einen Weg, in Anopheles Mücken eine Resistenz zu erzeugen, die den Malaria-Erreger abtötet und die Infektion von Menschen verhindert.15 Derartige Gene Drive Organismen hatten sich in ersten Käfigversuchen allerdings nur als eingeschränkt lebensfähig erwiesen.16
In gemäßigten Klimazonen wird über den Einsatz von Gene Drives gegen die Infektionskrankheit Borreliose (Lyme-Krankheit) nachgedacht. In den USA breitete sich die Borreliose zuletzt (2013-2018) stark aus und betrifft jährlich etwa 300 000 Menschen.17 Für Deutschland wird nach einer Hochrechnung aus dem Jahr 2017 die Zahl der Neuerkrankungen auf ungefähr 100 000 pro Jahr geschätzt.18
Auslöser für diese Krankheit sind Borrelien-Bakterien, die häufig wildlebende Mäuse befallen und von Zecken auf den Menschen übertragen werden. Wird die Infektion nicht rechtzeitig erkannt, kann sich eine chronische, schwer behandelbare Krankheit ausbilden.
Auf zwei Inseln im Nordosten der USA startete im Jahr 2016 ein Projekt, das die Übertragung der Krankheit mithilfe der Gentechnik unterbrechen will. Ziel der Genmanipulation sind nicht die Zecken als Überträgerinnen, sondern die einheimischen Weißfuß-Mäuse, die in diesen Regionen der wichtigste Wirt für Borrelien sind. Ein Eingriff in das Immunsystem soll die Mäuse resistent machen und die Übertragungskette der Borrelien unterbrechen.
Nach einer Bürger*innenbefragung auf den Inseln Nantucket und Martha’s Vineyard in Massachusetts, USA, lehnte eine Mehrheit den Einsatz von Gene Drives ab. Geplant ist stattdessen nun die massenhafte Freisetzung von gentechnisch veränderten Mäusen, die sich mit ihren natürlichen Artgenossen paaren und eine Borrelien-Resistenz in die Population einkreuzen sollen. Sollten langfristig jedoch Versuche auf größeren Landmassen geplant werden, stünde der Einsatz von Gene Drive Mäusen erneut zur Debatte.19
Der Einsatz eines Gene Drives und anderer gentechnischer Methoden, die die Übertragung der Borreliose auf Menschen verhindern soll, erfolgt jedoch nicht aus Mangel an Alternativen. Eine Infektion bereits mit einfachen Mitteln verhindert werden kann: durch passende Kleidung, das Auftragen von Anti-Zecken-Mitteln und regelmäßiges Absuchen des Körpers. Für kurze Zeit war in der Vergangenheit ein Impfstoff der amerikanischen Firma GlaxoSmithKline (GSK) verfügbar, der allerdings aufgrund mangelnden Interesses wieder vom US-Markt genommen wurde.
Mit Gene Drives gegen invasive Arten
Menschen haben zahlreiche Tierarten auf fremde Inseln und Kontinente verschleppt, wo sie zu einer ernsten Bedrohung für die einheimische Tier- und Pflanzenwelt wurden. Große Probleme bereiten beispielsweise eingeschleppte Ratten und Mäuse, die kleinere Tiere und die Brut einheimischer Vögel erheblich dezimieren. Konventionelle Maßnahmen wie Jagd, Fallen oder Giftköder konnten invasive Tierarten von kleinen Inseln vertreiben. Auf größeren Landmassen geraten diese Maßnahmen an ihre Grenzen. Gene Drives sollen hier eine Alternative bieten.
Ob dieser Weg erfolgsversprechend ist, untersucht das Projekt Genetic Biocontrol of Invasive Rodents (GBIRd), das von sieben Universitäten, Behörden und nicht-staatlichen Organisationen aus den USA und Australien getragen wird.
GBIRd will die Frage klären, ob invasive Mäuse durch Gene Drives ausgerottet werden können und unter welchen Bedingungen dieser Eingriff akzeptabel wäre. Der Großteil des Projekts wird von der US-Militärbehörde Defense Advanced Research Projects Agency (DARPA) mit 6,4 Millionen US-Dollar gefördert.20 Zu den aktivsten Mitgliedern von GBIRd gehört die kleine Naturschutzorganisation Island Conservation Seit 25 Jahren widmet sie sich dem Schutz von Seevögeln und hat nach eigenen Angaben bereits 63 Inseln von Nagetieren befreit. Bislang geschah dies mit konventionellen Methoden, doch für weitere Fortschritte hält Island Conservation den Einsatz von Gene Drives notwendig.21
Erste Schritte in dieser Richtung erfolgten an der Universität von Kalifornien in San Diego, USA, als dort 2019 erstmals Gene Drives für Mäuse entwickelt wurden.22 Die Entwickler*innen trafen dabei jedoch auf ein unerwartetes Phänomen: CRISPR/Cas9 konnte zwar den DNA-Strang in allen Versuchstieren schneiden, doch nur bei Weibchen setzte auch der Reparaturmechanismus ein, der die neuen DNA-Abschnitte aktiv im Erbgut verbreitet. Der Gene Drive war also nur in einem der beiden Geschlechter erfolgreich und selbst dort erreichte er nur eine Effizienz von etwa 70 Prozent. Für die Manipulation freilebender Populationen ist der Gene Drive in dieser Form wohl nicht geeignet. Auch Neuseelands ehemalige Regierung zeigte Interesse am Einsatz von Gene Drives. Die einzigartige Flora und Fauna des Landes erleidet durch Ratten, Hermeline und den australischen Fuchskusu großen Schaden. Mit dem Programm Predator Free 2050 verfolgt die neuseeländische Regierung das Ziel, alle invasiven Raubtiere bis zum Jahr 2050 auszurotten. Auf mehr als 100 kleineren Inseln sind die Maßnahmen bereits erfolgreich gewesen. Um auch auf den Hauptinseln Erfolge zu erzielen, wurde über den Einsatz von Gene Drives nachgedacht.
Angesichts der Überlegungen, in Neuseeland Gene Drives für die Ausrottung invasiver Arten zu nutzen, veröffentlichten im Jahr 2017 zwei Gene Drive Entwickler einen Artikel, in dem sie vor vorschnellen Freisetzungen und der Anwendung von Gene Drive Organismen im Naturschutz warnten. 23 Seit dem Regierungswechsel im gleichen Jahr herrscht in Neuseeland größere Zurückhaltung. Bevor sich Predator Free wieder mit dem Thema befasst, sollen erst die zahlreichen technischen, sozialen und ethischen Erwägungen und regulatorischen Hürden erforscht und überwunden werden.24
Die Diskussion um Gene Drives in der Weltnaturschutz-Union (IUCN)
Angesichts der Möglichkeit, eingeschleppte invasive Arten mittels Gene Drive aus empfindlichen Ökosystemen zu entfernen, diskutiert auch die International Union for Conservation of Nature (IUCN), auch Weltnaturschutzunion genannt, seit Ende 2015 über den Umgang mit dieser Technologie.
Bei ihrer Mitgliederversammlung im September 2016 auf Hawaii verabschiedete die IUCN eine Resolution25, mit der sie sich unter anderem selbst den Auftrag erteilte, einen wissenschaftlichen Bericht zu den Auswirkungen der synthetische Biologie und Gene Drives für den Schutz der Biodiversität zu erstellen. Auf Grundlage dieses wissenschaftlichen Berichts wollte die IUCN ursprünglich bei ihrer darauffolgenden Mitgliederversammlung im Jahr 2020 eine Position zur Rolle der Gene Drive Technologie für den Naturschutz beziehen.
Unter anderem durch öffentlichen Protest und auf Hinwirken von Koryphäen des weltweiten Natur- und Artenschutzes26 verpflichtete sich die IUCN in ihrer Resolution aus dem Jahr 2016 darauf, bis zum Vorliegen dieses Berichts von jeglicher Unterstützung oder Befürwortung von Forschung, Feldversuchen oder Nutzung der Gene Drive Technologie abzusehen.
Der Bericht mit dem Titel Genetic Frontiers of Conservation27 wurde im Mai 2019 veröffentlicht und traf sowohl aufseiten von IUCN Mitgliedsorganisationen als auch von Naturschutz- und Entwicklungsorganisationen aus aller Welt auf harsche Kritik. Eine von der kanadischen Nichtregierungsorganisation ETC Group durchgeführte Analyse27 kam zu dem Schluss, dass eine Mehrzahl der Autor*innen des Berichts bekannte Befürworter*innen der Gentechnik seien und zum Teil aufgrund ihrer wirtschaftlichen Eigeninteressen an der Entwicklung der untersuchten Technologien nicht von der IUCN hätten engagiert werden dürfen. In einem daraufhin von 231 zivilgesellschaftlichen Organisationen und mehreren Wissenschaftler*innen unterzeichneten offenen Brief wurde der Bericht als „bedauerlicherweise einseitig“, „voreingenommen“ und „ungeeignet für die vorgesehene politische Diskussion“ kritisiert. Dieser Bericht stehe nicht im Einklang mit den Vorsorgeerwägungen der Resolution von Hawaii. Die unterzeichnenden Organisationen forderten die IUCN deshalb dazu auf, einen weiteren wissenschaftlichen Bericht auf Basis einer vorsorgeorientierten Analyse der Risiken der Technologie in Auftrag zu geben und mit einer Beschlussfassung zum Thema bis zum Vorliegen eines solchen Gegenberichts zu warten.28 In eine ähnliche Richtung ging die Forderung eines Briefes von 23 IUCN Mitgliedern29 vom Oktober 2019 an den IUCN Council. Es brauche mehr Zeit für eine grundlegende, umfassende, ausgewogene Diskussion auf Grundlage des Vorsorgeprinzips mit größerer Einbindung von IUCN Mitgliedern vor einer Beschlussfassung der IUCN.30
Konfrontiert mit dieser Kritik zog der Rat der IUCN seinen Plan zurück, bereits bei seinem ursprünglich im Juni 2020 geplanten Mitgliederprozess eine Position beschließen zu wollen. Stattdessen werden in einer mitgliederoffenen Konsultation Prinzipien31 für die Diskussion rund um das Thema festgelegt. Diese sollen beim IUCN Weltnaturschutzkongress im Jahr 2021 abgestimmt und als Grundlage für eine Positionsfindung zum Thema bis zum darauffolgenden Mitgliederkongress dienen.
Gene Drives in der industriellen Landwirtschaft
Auf lange Sicht könnte die Landwirtschaft das wichtigste Anwendungsfeld von Gene Drives werden – ein Umstand, der von der Öffentlichkeit bislang kaum wahrgenommen wird. Patente zu CRISPR-basierten Gene Drives führen hunderte Tiere und Pflanzen auf, deren Eindämmung oder Ausrottung die landwirtschaftlichen Erträge steigern könnten. Allerdings müssten auf diesem Weg noch einige Hürden überwunden werden.
Mindestens sechs Patente zu Gene Drives verweisen auf konkrete Anwendungen in der Landwirtschaft. Der Fokus liegt auf der Kontrolle von Schädlingen und Unkräutern sowie der Rücknahme von Herbizidresistenzen.
Zwei zentrale Anmeldungen stammen von führenden Entwicklern des CRISPR/Cas basierten Gene Drive, den Forschungsgruppen um Kevin Esvelt32 und Ethan Bier33. Zahlreiche Ansprüche meldet auch ein Patent der Gruppe um Bruce Hay34 an. Meist sind die Ansprüche allgemein gehalten, doch ein Patent enthält bereits detaillierte Ziele und Methoden, die eine kommerzielle Nutzung ermöglichen.
Die Kommerzialisierung der Gene Drives steht jedoch vor einem grundsätzlichen Problem: Seine Verbreitung lässt sich bislang weder räumlich noch zeitlich eingrenzen. Einzelne Freisetzungen könnten eine grenzüberschreitende Verbreitung der GDO in benachbarte Ökosysteme für Jahrzehnte zur Folge haben. Das klassische Geschäftsmodell der Agrarunternehmen, das auf einen kontinuierlichen Verkauf der Produkte aufbaut, wäre unter diesen Bedingungen nur schwer anwendbar.
In der Theorie erscheint der Einsatz nur in zwei Szenarien kommerziell interessant. Ein Gene Drive könnte natürliche Resistenzen beseitigen, die Wildpflanzen gegen verbreitete Herbizide entwickelt haben. Ein Agrarunternehmen könnte dann vom gestiegenen Absatz des Herbizids profitieren, weil diese wieder einsatzfähig würden. Oder große Landwirtschaftsverbände die Entwicklung eines Gene Drive finanzieren, der allen Verbandsmitgliedern zugutekommt.
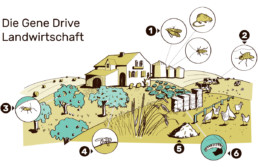
Diese Abbildung illustriert, in welchen Bereichen Gene Drive Organismen für die landwirtschaftliche Anwendung entwickelt oder in Betracht gezogen werden.
- Gene Drives, um z.B. Ratten, Mäuse, Schaben und Motten auszurotten, die Getreidesilos befallen.
- Gene Drives, um z.B. die Neuwelt-Schraubenwurmfliege auszurotten, welche ihre Eier in Körperöffnungen und Wunden von Kühen und anderen Nutztieren legt.
- Gene Drives zur Ausrottung der Kirschessigflieg, die ihre Eier in reife Früchte, wie z.B. Kirschen legt.
- Gene Drives, um z.B. Blattflöhe auszurotten, welche die Cirtrus Greening Krankheit (Huanglongbing) bei Zitrusfrüchten verbreiten.
- Gene Drives, um Nematoden auszurotten, die Pflanzenkrankheiten auslösen.
- Gene Drives, um z.B. die Kohlmotte zu dezimieren
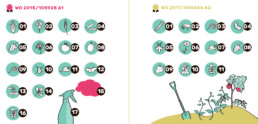
Diese Abbildung illustriert die wichtigsten möglichen zukünftigen landwirtschaftlichen Gene Drive Verwendungsmöglichkeiten, für die sich die Patentinhaber*innen auf die Gene Drive Technologie vorsorglich Patentansprüche gesichert haben.
Patent WO 2015 /105928 A1
- Maisschädlinge
- Baumwollschädlinge
- Schädlinge für kleinkörniges Getreide
- „im Rahmen der vorliegenden Offenlegung“ genannte Sojaschädlinge
- Traubenschädlinge
- Palmenschädlinge
- Schädlinge für Nachtschattengewächse, darunter Paprika, Tomaten, Auberginen, Tabak, Petunien, Kartoffeln
- Steinobstschädlinge
- Zystennematodenarten
- Borkenkäferarten
- Schädlinge der Weichtiergattung
- Mottenarten
- genannte Agrarunternehmen
- schädliche Unkrautarten (19 Sorten Wasserunkraut, 5 parasitäre Unkrautsorten, 88 terrestrische Unkrautsorten)
- Pestizidsorten, z.B. Atrazin, Glyphosat, Napthalin, Kupferhydroxid
- schädliche Unkrautarten (19 Sorten Wasserunkraut, 5 parasitäre Unkrautsorten, 88 terrestrische Unkrautsorten)
- Markenherbizide
Patent WO 2017 / 049266 A2
- landwirtschaftliche Insektenschädlinge
- landwirtschaftliche Milben
- landwirtschaftliche Nematodenarten
- pflanzenpathogene Nematoden
- Insektenvektoren von Pflanzenpathogenen
- Insektenschädlinge für Zierpflanzen
- Schädlinge der Weichtiergattung
- Traubenschädlinge
- Erbeerschädlinge
- Schädlinge für Honigbienen
- gegen Pestizide oder Herbizide resistente Unkräuter
Beispiele für landwirtschaftliche Anwendungen von Gene Drives
Der Einsatz von Gene Drives wäre bei fast jeder Feldfrucht und bei zahlreichen Nutztieren oder sogenannten Schädlingen vorstellbar. In drei Fällen gibt es bereits konkrete Pläne.
Die ursprünglich in Südostasien beheimatete Kirschessigfliege (Drosophila suzukii) hat sich weltweit ausgebreitet und verursacht erhebliche Ernteausfälle bei zahlreichen Obstsorten. Sie legt ihre Eier in fast reife, unbeschädigte Früchte mit dünnen Schalen. Im Jahr 2008 erreichte die Kirschessigfliege Kalifornien und verursachte bereits im folgenden Jahr Schäden von über 38 Millionen US-Dollar in Kirschplantagen. Berechnungen zufolge können diese Verluste im Westen der USA auf jährlich über 500 Millionen US-Dollar ansteigen.35 Seit 2011 tritt sie auch in Deutschland auf und gefährdet die Ernte von Kirschen, Weintrauben, Himbeeren, Brombeeren und Erdbeeren.36 Der Verband der kalifornischen Kirschenanbauern und – bäuerinnen, das California Cherry Board, begann im Jahr 2013, die Forschung für einen Gene Drive mit jährlich 100 000 US-Dollar zu finanzieren.37 Eine Forscher*innengruppe an der Universität von San Diego, USA, entwickelte einen sogenannten Medea Drive. Die Nachkommen der Fliegen sind nicht lebensfähig. Dies kann nur eins oder beide Geschlechter betreffen. (Siehe Abbildung)
In ersten Laborexperimenten war eine hohe Zahl von veränderten Fliegen notwendig, um den Medea Drive in der Population durchzusetzen. Zudem weisen in der freien Natur viele Fliegenpopulationen natürliche Resistenzen auf, die eine Verbreitung des Medea Drive wohl stark behindern würden. Die Forscher*innen vermuten daher, dass eine sehr große Zahl von veränderten Kirschessigfliegen freigesetzt werden müsste, um den Medea Drive für mehrere Jahre in der Population zu halten. Freilandtests sind bisher noch keine geplant.38 Das im Jahr 2017 auf diesen Medea Drive angemeldete Patent gilt auch für andere Arten von tropischen Fruchtfliegen sowie für Stechmücken der Gattungen Anopheles und Aedes, die Malaria und zahlreiche Viruserkrankungen übertragen.39
Weitere potentielle Zielorganismen für einen Gene Drive sind Blattflöhe. Im Jahr 2005 wurden in den USA erstmals Bakterien nachgewiesen, die Zitrusbäume befallen und deren Früchte ungenießbar machen. Die Verbreitung erfolgt durch eingeschleppte asiatische Blattflöhe, die beim Saugen von Pflanzensaft die Bakterien aufnehmen und dann weitere Bäume infizieren können. Innerhalb von drei Jahren hat sich die Krankheit mit Namen Huanglongbing über die meisten Anbaugebiete Floridas ausgebreitet, die Produktion von Zitrusfrüchten brach dabei um 70 Prozent ein.40 Europa blieb bislang von der Krankheit verschont, eine Verschleppung kann aber nicht ausgeschlossen werden.41 Die Zitrusfrüchteproduzent*innen in Kalifornien erwägen zum Schutz ihrer Anbaugebiete unter anderem auch den Einsatz von Gene Drives.42 Eine Möglichkeit wäre die Freisetzung von Gene Drive Blattflöhen, die die Bakterien nicht übertragen können. Ein Forschungsprojekt hierzu wurde 2017 abgeschlossen und hat eine Reihe von Genen identifiziert, die eine Übertragung verhindern könnten.43 Ein Gene Drive wurde daraus bislang jedoch noch nicht etabliert.
Die Neuwelt-Schraubenwurmfliege (Cochliomyia hominivorax) kommt vor allem auf dem amerikanischen Kontinent vor und legt ihre Eier in der Nähe von Körperöffnungen oder offenen Wunden von Säugetieren und Vögeln. Die schlüpfenden Larven fressen sich tief in das Gewebe der befallenen Tiere ein und verursachen schwere Entzündungen. Die Neuwelt-Schraubenwurmfliege befällt auch Nutztiere wie Kühe, Schafe und Ziegen, die ohne tierärztliche Behandlung an der Entzündung sterben können.44 Die Schraubenwurmfliege wurde in den 1960er Jahren auf dem Festland der USA und in Zentralamerika durch die Freisetzung von sterilen männlichen Fliegen ausgerottet. Um eine Neueinwanderung aus Südamerika zu verhindern, wurde eine Schutzzone in Panama eingerichtet, deren Aufrechterhaltung jedoch sehr kostspielig ist. Wissenschaftler*innen der Universität North Carolina, USA, schlugen daher den Einsatz von Gene Drives vor.45 Zudem wäre auch die Ausrottung der Schraubwurmfliege in Südamerika damit denkbar. Eine internationale Forscher*innengruppe konnte 2019 erstmals mit CRISPR/Cas9 in der Schraubwurmfliege anwenden und ein Gen der Fliege verändern, das für die Entwicklung des Geschlechts der Fliegen entscheidend ist. Dadurch entstanden Weibchen, die männliche Geschlechtsmerkmale aufwiesen und vermutlich steril waren46 . Dieser Eingriff ist ein erster Schritt zur Entwicklung eines CRISPR/Cas basierten Gene Drive, der die vollständige Ausrottung der Schraubenwurmfliege zum Ziel hätte.
Theoretisch könnten Gene Drives auch bei Pflanzen eingesetzt werden. Die U.S. National Academies of Science identifizierte als eines der möglichen Ziele das Fuchsschwanzgewächs Amaranthus palmeri47, welches sich seit den 1990er Jahren in den USA durch den übermäßigen Einsatz von Herbiziden wie Glyphosat zu einem resistenten „Super-Unkraut“ entwickelt hat.48 Amaranthus palmeri gehört zu den zweihäusigen Pflanzen, die entweder männliche oder weibliche Blüten ausbilden. Forscher*innen identifizierten kürzlich ein Gen, das die Ausbildung weiblicher Blüten steuert.49 Sollte es möglich werden, dieses Gen durch einen Gene Drive auszuschalten, könnten sich nur noch männliche Pflanzen bilden und eine natürliche Vermehrung unmöglich machen.
Eine andere theoretische Möglichkeit wäre die Rücknahme von Resistenzen gegen gängige Pflanzenschutzmittel, die dutzende Pflanzenarten entwickelt haben und die die industrielle Landwirtschaft vor große Probleme stellt. Hinter diesen Resistenzen stehen genetische Veränderungen, die häufig gut erforscht sind und theoretisch durch einen Gene Drive zurückgenommen werden könnten.50 Vor einer Anwendung von Gene Drives in Pflanzen müssen allerdings noch einige technische Hürden überwunden werden. Pflanzliche Zellen reparieren den Doppelstrangbruch, der durch CRISPR/Cas9 in ihrem Erbgut verursacht wurde, meist mit fehleranfälligen Mechanismen.51 Das verhindert die Ausbereitung des Gene Drive in Pflanzen. Zur Vererbung des Gene Drive an alle Nachkommen müsste ein anderer Reparaturmechanismus den Doppelstrangbruch mit Hilfe einer Vorlage reparieren. Zudem haben viele Pflanzen deutlich längere Generationszeiten als Insekten: Die Wirkung eines Gene Drive käme also erst nach vielen Jahren zum Tragen. Und letztlich können die Samen mancher Pflanzen jahrelang in der Erde überdauern und den Durchbruch des Gene Drive deutlich verzögern.52 Die Realisierung eines Gene Drive in Pflanzen ist mit dem aktuellen Wissensstand noch nicht möglich.
Gene Drives als Biowaffen
Eine Freisetzung von Gene Drive Organismen kann großflächige und langanhaltende negative Effekte für Ökosysteme und Gesellschaften nach sich ziehen. Allein deshalb könnte selbst eine Freisetzung von Gene Drive Organismen zu zivilen Zwecken zu Konflikten herbeiführen oder zu Missbrauch führen. Auch die gezielte Entwicklung von Gene Drive Organismen zu feindlichen Zwecken ist denkbar.53
Eine Möglichkeit, wie Gene Drive Organismen als Biowaffen eingesetzt werden könnten, wäre, sie zur Ausrottung wichtiger Nutzinsekten für die Landwirtschaft in einer bestimmten Region zu gebrauchen. Solange sich Gene Drive Organismen und ihre schädliche Wirkung jedoch noch nicht räumlich oder zeitlich eingrenzen lassen, gibt es wenige überzeugende Szenarien für staatliche Gene Drive Waffenprogramme.54
Dennoch – oder gerade deshalb – ist die US-amerikanische Militärbehörde Defense Advanced Research Projects Agency (DARPA) eine der größten Geldgeberinnen der Gene Drive Forschung und finanziell in fast jedem Gene Drive Forschungsprojekt involviert.55 Das DARPA Forschungsprogramm mit dem Titel Safe Genes setzt sich zum Ziel, die Effekte von freigesetzten Gene Drive Organismen in der Umwelt zu steuern, zu begrenzen oder GDOs zurückzuholen.56 Im Spektrum zwischen unerwarteten negativen Effekten von Gene Drive Organismen in der Natur, ihrem Missbrauch und der gezielten Entwicklung von Gene Drives zu feindlichen Zwecken gibt es zahlreiche Grauzonen: Während der Effekt eines Gene Drive Organismus in einer bestimmten Region als positiv eingeschätzt werden könnte, könnten dessen Folgen in anderen betroffenen Regionen als unerwünscht oder negativ erachtet werden und zu Aufständen oder Konflikten führen.
Konflikte durch den Einsatz der Gene Drive Technologie in der Umwelt könnten auch durch einen fehlenden öffentlichen (oder internationalen) Konsens über eine Freisetzung von Gene Drive Organismen im eigenen oder in Nachbarländern ausgelöst werden. Entstandene Schäden, wie z.B. Ernteverluste, Biodiversitätsverlust oder ungewollte gesundheitliche, soziale oder ökonomische Effekte, können zu Konflikten führen, wenn es dafür keine angemessene Entschädigung gibt. Bereits die ungewollte Präsenz eines GDO in einem Land, das einer Freisetzung nicht zugestimmt hat, kann zu zwischenstaatlichen Konflikten oder diplomatischen Krisen führen.57 Aus diesen Gründen beobachten und diskutieren Expert*innen der UN-Biowaffenkonvention das Thema seit Jahren.58
- World Health Organization, and the United Nations Children’s Fund (2015). Achieving the malaria MDG target: reversing the incidence of malaria 2000–2015. Online: https://www.who.int/publications/i/item/9789241509442 [letzter Zugriff: 04.07.2022]
- World Health Organization Website (2019). World Health Organisation. Countries and territories certified malaria-free by WHO. Online: https://www.who.int/teams/global-malaria-programme/elimination/countries-and-territories-certified-malaria-free-by-who [letzter Zugriff: 04.07.2022]
- Global Malaria Programme, World Health Organization (2019). The E-2020 initiative of 21 Malaria-eliminating countries. 2019 progress report. Online: https://apps.who.int/iris/bitstream/handle/10665/325304/WHO-CDS-GMP-2019.07-eng.pdf?ua=1 [letzter Zugriff: 09.03.2020]
- World Health Organization (2018). World Malaria Report 2018. World Health Organization. Online: https://www.who.int/publications/i/item/9789241565653 [letzter Zugriff: 04.07.2022]
- Regalado A, MIT Technology Review Website (2016). MIT Technology Review; c2020. Bill Gates Doubles His Bet on Wiping Out Mosquitoes with Gene Editing. Online: https://www.technologyreview.com/s/602304/bill-gates-doubles-his-bet-on-wiping-out-mosquitoes-with-gene-editing/ [letzter Zugriff: 09.03.2020]
- Dunning H, Imperial College London Website (2017). London: Imperial College London; c2020. Malaria elimination project wins $17.5m funding boost. Online: https://www.imperial.ac.uk/news/179689/malaria-elimination-project-wins-175m-funding/ [letzter Zugriff: 09.03.2020]
- Kyrou K, Hammond AM, Galizi R, Kranjc N, Burt A, Beaghton AK, Nolan T, Crisanti A (2018). A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nat Biotechnol 36:1062
- Windbichler N, Papathanos PA, Crisanti A (2008). Targeting the X chromosome during spermatogenesis induces Y chromosome transmission ratio distortion and early dominant embryo lethality in Anopheles gambiae. PLoS Genet 4 (12):e1000291
- Diabate A, Target Malaria Website. (2019). Target Malaria; 2020. Target Malaria proceeded with a small-scale release of genetically modified sterile male mosquitoes in Bana, a village in Burkina Faso. Online: https://targetmalaria.org/target-malaria-proceeded-with-a-small-scale-release-of-genetically-modified-sterile-male-mosquitoes-in-bana-a-village-in-burkina-faso/ [letzter Zugriff: 09.03.2020]
- Wallace H, Li Ching L, Mayet M, African Center for Biodiversity Website (2018). African Center for Biodiversity. Release of risky GM mosquitoes in Burkina Faso highly unethical. Online: https://www.acbio.org.za/en/release-risky-gm-mosquitoes-burkina-faso-highly-unethical [letzter Zugriff: 09.03.2020]
- Fuhr L, Klima der Gerechtigkeit Website (2018). Heinrich-Böll-Stiftung e.V. Burkina Faso’s Mosquito Controversy: Consent, awareness and risk assessment in Target Malaria’s gene drive project. Online: https://klima-der-gerechtigkeit.de/2018/11/20/burkina-fasos-mosquito-controversy-consent-awareness-and-risk-assessment-in-target-malarias-gene-drive-project/ [letzter Zugriff: 09.03.2020]
- Galizi R, Doyle LA, Menichelli M, Bernardini F, Deredec A, Burt A, Stoddard BL, Windbichler N, Crisanti A (2014). A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nat Commun 10:3977
- Target Malaria Website (2022). Our Work: Self-sustaining. Online: https://targetmalaria.org/what-we-do/our-work/ [letzter Zugriff: 04.07.2022]
- Philanthropy News Digest Website (2016). c2020. Tata Trust Awards $70 Million to UC San Diego for Genetics Institute. Online: https://philanthropynewsdigest.org/news/tata-trusts-awards-70-million-to-uc-san-diego-for-genetics-institute [letzter Zugriff: 09.03.2020]
- Gantz VM, Jasinskiene N, Tatarenkova O, Fazekas A, Macias VM, Bier E, James AA (2015). Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proc Natl Acad Sci USA. 8:E6736
- Pham TB, Phong CH, Bennett JB, Hwang K, Jasinskiene N, Parker K, Stillinger D, Marshall JM, Carballar-Lejarazú R, James AA (2019). Experimental population modification of the malaria vector mosquito, Anopheles stephensi. PLoS Genet. 15:e1008440
- Centers for Disease Control and Prevention Website (2019). U.S. Department of Health & Human Services. Lyme Disease – Data and Surveillance. Online: https://www.cdc.gov/lyme/datasurveillance/index.html [letzter Zugriff: 09.03.2020]
- Robert Koch-Institut Website (2018). Robert Koch-Institut. Borreliose – Antworten auf häufig gestellte Fragen zu Borreliose. Online: https://www.rki.de/SharedDocs/FAQ/Borreliose/Borreliose.html [letzter Zugriff: 09.03.2020
- Buchthal J, Evans SW, Lunshof J, Telford SR 3rd, Esvelt KM (2019). Mice Against Ticks: an experimental community-guided effort to prevent tick-borne disease by altering the shared environment. Philos Trans R Soc Lond B Biol Sci 374:20180105
- Neslen A, The Guardian Website (2017). Guardian News & Media Limited; c2020. US military agency invests $100m in genetic extinction technologies. Online: https://www.theguardian.com/science/2017/dec/04/us-military-agency-invests-100m-in-genetic-extinction-technologies [letzter Zugriff: 09.03.2020]
- Grunwald HA, Gantz VM, Poplawski G, Xu XS, Bier E, Cooper KL (2019). Super-Mendelian inheritance mediated by CRISPR-Cas9 in the female mouse germline. Nature 566:105
- Esvelt KM, Gemmell NJ (2017). Conservation demands safe gene drive. PLoS Biol. 15:e2003850
- Murphy EC, Russel JC, Broome KG, Ryan GJ, Dowding JE (2019). Conserving New Zealand’s native fauna: a review of tools being developed for the Predator Free 2050 programme. Journal of Ornithology 160:883
- IUCN Library System Website (2016). IUCN, International Union for Conservation of Nature Resolution; c2020. WCC-2016-Res-086 – Development of IUCN policy on biodiversity conservation and synthetic biology. World Conservation Congress; 2016; Hawaii. Online: https://portals.iucn.org/library/sites/library/files/resrecfiles/WCC_2016_RES_086_EN.pdf [letzter Zugriff: 12.03.2020]
- SynBioWatch Website (2016). A Call for Conservation with a Conscience. No Place for Gene Drives in Conservation. Online: http://www.synbiowatch.org/wp-content/uploads/2016/09/letter_vs_genedrives.pdf [letzter Zugriff: 09.03.2020]
- Redford KH, Brooks TM, Macfarlane NBW, Adams JS (2019). Genetic frontiers for conservation: an assessment of synthetic biology and biodiversity conservation: technical assessment. IUCN Publication. Online: https://portals.iucn.org/library/node/48408 [letzter Zugriff: 12.03.2020]
- ETC Group Website (2019). ETC Group. Driving Under the Influence? A review of the evidence for bias and conflict of interest in the IUCN report on synthetic biology and gene drive organisms. Online: https://www.etcgroup.org/sites/www.etcgroup.org/files/files/etc-iucn-driving_under_influence.pdf [letzter Zugriff: 09.03.2020]
- GeneWatch UK Website (2019). GeneWatch UK. Open letter to the IUCN regarding the report Genetic Frontiers for Conservation. Online: http://www.genewatch.org/uploads/f03c6d66a9b354535738483c1c3d49e4/IUCN_let_16July2019.pdf [letzter Zugriff: 09.03.2020]
- Institute for Nature Conservation in Albania Website (2019). Instituti për Ruajtjen e Natyrës në Shqipëri. Open Letter by the undersigned IUCN Members to the IUCN Council. Online: https://www.inca-al.org/old/en/publication/dokumente/item/844-open-letter-by-the-undersigned-iucn-members-to-the-iucn-council [letzter Zugriff: 22.10.2020]
- IUCN Congress 2020 Website (2020). IUCN; c2020. 075 – IUCN Principles on Synthetic Biology and Biodiversity Conservation. Online: https://www.iucncongress2020.org/motion/075 [letzter Zugriff: 11.03.2020]
- Esvelt KM, Smidler AL (2015). RNA-guided gene drives. Patent No. WO/2015/105928
- Bier E, Gantz V (2016). Method for autocatalytic genome editing and neutralizing autocatalytic genome editing. Patent No. WO/2016/073559
- Hay BA, Oberhofer G, Ivy TW (2018). DNA sequence modification-based gene drive. Patent No. WO 2018/204722A1
- Walsh DB, Bolda MP, Goodhue RE, Dreves AJ, Lee J, Bruck DJ, Walton VM, O’Neal SD, Zalom FG (2011). Drosophila suzukii (Diptera: Drosophilidae): invasive pest of ripening soft fruit expanding its geographic range and damage potential. Journal of Integrated Pest Management 2: G1
- Bundesministerium für Ernährung und Landwirtschaft Website (2019). Bundesministerium für Ernährung und Landwirtschaft. Kirschessigfliege: Herkunft und Bedeutung. Online: https://www.bmel.de/DE/Landwirtschaft/Pflanzenbau/Pflanzenschutz/_Texte/Kirschessigfliege_Management.html [letzter Zugriff: 22.10.2020]
- Regalado A, MIT Technology Review Website (2017). MIT Technology Review; c2020. Farmers Seek to Deploy Powerful Gene Drive. Online: https://www.technologyreview.com/s/609619/farmers-seek-to-deploy-powerful-gene-drive/ [letzter Zugriff: 22.10.202020]
- Buchman A, Marshall JM, Ostrovski D, Yang T, Akbari OS (2018). Synthetically engineered Medea gene drive system in the worldwide crop pest Drosophila suzukii. PNAS 115:4725
- Akbari OS, Buchman A (2017). Use of medea elements for biocontrol of D. suzukii populations. Patent No. WO 2017/132207
- Citrus Research Board (2017). CLB HLB external scientific review – Final report. 2017 Aug 14-18; Davis, California, USA. Online: http://citrusresearch.org/wp-content/uploads/HLB-External-Review_FINAL-Report.pdf [letzter Zugriff: 22.10.2020]
- Pérez-Rodríguez J, Krüger K, Pérez-Hedo M, Ruíz-Rivero O, Urbaneja A, Tena A (2019). Classical biological control of the African citrus psyllid Trioza erytreae, a major threat to the European citrus industry. Sci Rep 9:9440
- Citrus Research Board (2017). CLB HLB external scientific review – Final report. 2017 Aug 14-18; Davis, California, USA. Online: http://citrusresearch.org/wp-content/uploads/HLB-External-Review_FINAL-Report.pdf [letzter Zugriff: 22.10.2020]
- United States Department of Agriculture Website, Citrus Research and Development (2017). United States Department of Agriculture. Source: Citrus Research & Development Foundation (CRDF) submitted to Rear and Release Psyllids as Biological Control Agents – An Economical and Feasible Mid-Term Solution for Huanglongbing (HLB) Disease. Online: https://reeis.usda.gov/web/crisprojectpages/0230893-rear-and-release-psyllids-as-biological-control-agents–an-economical-and-feasible-mid-term-solution-for-huanglongbing-hlb-disease.html [letzter Zugriff: 22.10.2020]
- Scott MJ, Concha C, Welch JB, Philips PL, Skoda SR (2017). Review of research advances in the screwworm eradication program over the past 25 years. Entomologia Experimentalis et Applicata 164:226
- Paulo DF, Williamson ME, Arp AP, Li F, Sagel A, Skoda SR, Sanchez-Gallego J, Vasquez M, Quintero G, Pérez de León AA, Belikoff EJ, Azeredo-Espin AML, McMillan WO, Concha C, Scott MJ (2019). Specific Gene Disruption in the Major Livestock Pests Cochliomyia hominivorax and Lucilia cuprina Using CRISPR/Cas9. G3:Genes, Genomes, Genetics 9:3045
- Paulo DF, Williamson ME, Arp AP, Li F, Sagel A, Skoda SR, Sanchez-Gallego J, Vasquez M, Quintero G, Pérez de León AA, Belikoff EJ, Azeredo-Espin AML, McMillan WO, Concha C, Scott MJ (2019). Specific Gene Disruption in the Major Livestock Pests Cochliomyia hominivorax and Lucilia cuprina Using CRISPR/Cas9. G3:Genes, Genomes, Genetics 9:3045
- National Academies of Sciences, Engineering, and Medicine (2016). Gene Drives on the Horizon: Advancing Science, Navigating Uncertainty, and Aligning Research with Public Values. Washington, DC: The National Academies Press.
- Webster TM, Nichols RL (2012). Changes in the prevalence of weed species in the major agronomic crops of the Southern United States: 1994/1995 to 2008/2009. Weed Science 60:145
- Montgomery JS, Sadeque A, Giacomini DA, Brown JB, Tranel PJ (2019) Sex-specific markers for waterhemp (Amaranthus tuberculatus) and Palmer amaranth (Amaranthus palmeri). Weed Science 67:412
- Neve P (2018). Gene drive systems: do they have a place in agricultural weed management? Pest Manag Sci 74:2671
- Hahn F, Eisenhut M, Mantegazza O, Weber APM (2018). Homology-Directed Repair of a Defective Glabrous Gene in Arabidopsis With Cas9-Based Gene Targeting. Frontiers in Plant Science 9:424
- Barrett LG, Legros M, Kumaran N, Glassop D, Raghu S, Gardiner DM (2019). Gene drives in plants: opportunities and challenges for weed control and engineered resilience. Proc Biol Sci. 286:20191515
- National Academies of Sciences, Engineering, and Medicine (2016). Gene Drives on the Horizon: Advancing Science, Navigating Uncertainty, and Aligning Research with Public Values. Washington, DC: The National Academies Press. p. 161
- Jeremias G (2019). Governing the Conflict Potential of Novel Environmental Biotechnologies (NEBs). BWC Meeting of State Parties; 2019 Dec 3. Online: https://www.unog.ch/80256EDD006B8954/(httpAssets)/FABC68A345728CFFC12584C7006218F4/$file/Conflict+potentials+from+Gene+Drives2.pdf [letzter Zugriff: 22.10.2020]
- Gene Drive Files Website (2017). Gene Drive Files. Gene Drive Files Expose Leading Role of US Military in Gene Drive Development. Online: http://genedrivefiles.synbiowatch.org/2017/12/01/us-military-gene-drive-development/ [letzter Zugriff: 22.10.2020] und: Gene Drive Files. AS notes on DARPA Safe Genes rollout San Diego May 2 2017. Online: http://genedrivefiles.synbiowatch.org/as-notes-on-darpa-safe-genes-rollout-san-diego-may-2-2017/ [letzter Zugriff: 22.10.2020]
- Defense Advanced Research Projects Agency Website (2019). Defense Advanced Research Projects Agency. Safe Genes Tool Kit Takes Shape – Successes in first two years of Safe Genes program establish technological foundations and ground truth in support of DARPA’s emerging, adaptable resources for secure genome editing research. Online: https://www.darpa.mil/news-events/2019-10-15 [letzter Zugriff: 22.10.2020]
- Jeremias G (2019). Governing the Conflict Potential of Novel Environmental Biotechnologies (NEBs). BWC Meeting of State Parties; 2019 Dec 3. Online: https://www.unog.ch/80256EDD006B8954/(httpAssets)/FABC68A345728CFFC12584C7006218F4/$file/Conflict+potentials+from+Gene+Drives2.pdf [letzter Zugriff: 22.10.2020]
- Chair of the Meeting of Experts on Review of Developments in the Field of Science and Technology Related to the Convention (2018). Meeting of Experts on Review of Developments in the Field of Science and Technology Related to the Convention: Reflections and proposals for possible outcomes. 2018 Meeting of the States Parties to the Convention on the Prohibition of the Development, Production and Stockpiling of Bacteriological (Biological) and Toxin Weapons and on Their Destruction; 2018 Dec 4-7; Geneva, Switzerland. Online: https://www.unog.ch/80256EDD006B8954/(httpAssets)/327ACB8D34AFD3C8C12583930032B711/$file/CRP_3.pdf [letzter Zugriff: 22.10.2020]